水产品提供了我国人民餐桌上约1/3的动物蛋白。然而,水生病毒往往给水产养殖业带来重大经济损失,其中鲤春病毒血症病毒(Spring viremia of carp virus,SVCV)和草鱼出血病病毒(Grass carp reovirus,GCRV)是鱼类病毒病的重要病原。一直以来,关于鱼类病毒是如何躲避鱼体免疫系统的逃逸机制尚不清楚。中国科学院水生生物研究所鱼类分子免疫学学科组近几年针对SVCV和GCRV的免疫逃逸机制开展了一系列的深入研究。
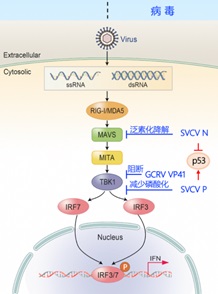
干扰素(Interferon,IFN)反应是鱼类天然免疫的重要组成部分,也是细胞抵抗病毒入侵的一道重要防线。该学科组前期工作发现SVCV的N蛋白能够通过泛素-蛋白酶体途径降解MAVS进而抑制宿主细胞IFN的产生(Journal of Immunology,2016),该研究结果被杂志以Fish Virus Is Unfriendly to IFN 为题重点推荐。紧接着,该学科组又发现SVCV的P蛋白能够模拟TBK1的底物,进而抑制TBK1的激酶活性从而阻断IFN的产生(Journal of Virology,2016)。另外,还发现了草鱼出血病病毒GCRV的S8节段编码蛋白能够阻断MITA的磷酸化,导致IFN减少(Journal of Virology,2017)。以上研究确认了鱼类病毒能够降低宿主IFN的产生,从而利于病毒增殖,这些内容为低等脊椎动物病毒免疫逃逸提供了强有力的证据。
p53作为一个肿瘤抑制蛋白,调控各种基因的表达,包括细胞凋亡、细胞生长抑制、细胞周期进程等。由于细胞周期调控以及凋亡与病毒感染的关系密不可分,从病毒的角度来讲,在感染早期控制细胞状态稳定能够获得更多的细胞内资源进行病毒复制;在感染晚期,则是促进细胞凋亡,促进病毒的释放。近期,该学科组发现SVCV的N蛋白和P蛋白能够分别降解和稳定p53的蛋白表达,从而为病毒的增殖提供最优条件。在SVCV感染的初期,细胞停滞在S期数量明显增多,同时SVCV的N蛋白与p53结合并引起p53蛋白水平的减少;在SVCV感染的后期,细胞产生明显凋亡现象,同时SVCV的P蛋白与p53结合并引起p53的蛋白表达增加;进一步发现p53的K358位点是N蛋白和P蛋白引起p53发生K63型多聚泛素化修饰的关键位点,从而精确控制p53表达量。揭示了鱼类病毒通过调控p53实现免疫逃逸,发现了病毒针对p53的两种截然不同的调控方式。研究结果以Spring viraemia of carp virus modulates p53 expression using two distinct mechanisms 为题,在线发表在PLoS Pathogens上。以上研究内容第一作者为副研究员李顺和(或)助理研究员陆龙凤。这些研究成果从病毒与细胞相互作用的角度阐明鱼病的致病机理,对于鱼病的检测、预防和清除,疫苗及诊断试剂的研制开发都具有重要意义。
鱼类病毒免疫逃逸机制



